Liaison dative/ liaison de coordination
Coucou 
Cours sur les orbitales :
Les liaisons de coordinations sont présentes au sein des complexes métalliques. C'est les liaisons qui unissent le métal aux ligands. Dans un complexe métallique, le ligand va fournir les 2 électrons nécessaires à la liaison (pas de mise en commun d'électrons comme c'est le cas des liaisons covalentes). Le métal va accepter ces deux électrons dans des case quantiques (orbitales) vides. Le métal doit avoir autant d'orbitales vides de même énergie que nécessaire pour y placer l'ensemble des électrons qu'il va recevoir de la part du ligand. Par exemple, un métal lié à 3 ligands par liaisons simples recevra donc au total 6 électrons. Il lui faudra donc libéré 3 orbitales de même énergie pour y placer les électrons (pour rappel, chaque orbitale atomique peut contenir au maximum 2 électron, et si nécessaire on peut hybrider des orbitales atomiques pour en obtenir suffisamment de même énergie).

Cours liaisons et électronégativité :
Les liaisons de coordinations, également appelées liaisons datives se fait avec des éléments des colonne 3 du bloc p, et les cations des éléments du groupe d. Ces éléments ne possèdent pas assez d'électrons pour pouvoir participer à des liaisons covalentes.
Prenons l'exemple du cours qui est l'atome de Bohr (numéro atomique = 5). Cet atome possède donc 5 électrons, sa première couche sera saturé (on place deux électrons dans cette couches, c'est la couche "K"). Sa deuxième couche (couche L) peut contenir jusqu'à 8 électrons, or nous pouvons en placer que 3. Plus les couches situées en périphérie sont saturées, plus le composé est stable. Pour que sa couche soit saturée, notre atome de Bohr devrait donc soit perdre 3 électrons (une couche vide n'existe plus), soit gagner 5 électrons, or ces deux possibilité coutent bien trop cher en énergie et sont donc impossible ! Pour ce qui est de la mise en commun d'électrons, notre atome peut donc partager uniquement ses 3 électrons de valences, seules 3 liaisons pourraient se faire et la couche K ne serait tout de même pas saturé (total de 6 électron), le composé de départ n'obtiendrait pas suffisamment de stabilité par la mise en commun d'électron. Cette solution est donc inutile.
Une dernière solution s'offre alors à nous, il s'agit du cas particulier de la liaison de coordination (ou dative). Cette solution permet à un atome qui est en excès d'électrons (éléments des colonnes 15, 16, et 17) de fournir les 2 électrons nécessaires à la liaison à notre atome en déficit d'électron. L'azote (numéro atomique = 7) possède 5 électrons sur sa couche externe, il pourrait donc saturer sa deuxième couche par la mise en commun de 3 de ses électron de valence (total de 8 électron). Il lui resterait donc un doublet électronique non utilisé, et disponible pour former à lui seul une éventuelle liaison (coordination : don d'un doublet d'électrons).
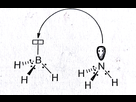
L'azote va par exemple se lier à 3 hydrogènes (mise en commun d'électrons) pour saturer ses couches et obtenir gain de stabilité (NH3). Il lui reste un doublet non liant. De son côté, le Bohr va faire de même, il se lie à 3 atomes d'hydrogènes par liaison covalente. On obtient donc un BH3 encore instable car ses couche ne sont pas saturées, ce composé est déficitaire en électron, il lui manque 2 électrons pour être stable. Le composé azoté va fournir au bohr son doublet d'électrons. Une liaison de coordination vient de se former entre l'atome de Bohr et l'atome d'azote, la stabilité de ce nouveau composé est optimal.
Cours sur les orbitales :
Les liaisons de coordinations sont présentes au sein des complexes métalliques. C'est les liaisons qui unissent le métal aux ligands. Dans un complexe métallique, le ligand va fournir les 2 électrons nécessaires à la liaison (pas de mise en commun d'électrons comme c'est le cas des liaisons covalentes). Le métal va accepter ces deux électrons dans des case quantiques (orbitales) vides. Le métal doit avoir autant d'orbitales vides de même énergie que nécessaire pour y placer l'ensemble des électrons qu'il va recevoir de la part du ligand. Par exemple, un métal lié à 3 ligands par liaisons simples recevra donc au total 6 électrons. Il lui faudra donc libéré 3 orbitales de même énergie pour y placer les électrons (pour rappel, chaque orbitale atomique peut contenir au maximum 2 électron, et si nécessaire on peut hybrider des orbitales atomiques pour en obtenir suffisamment de même énergie).

Cours liaisons et électronégativité :
Les liaisons de coordinations, également appelées liaisons datives se fait avec des éléments des colonne 3 du bloc p, et les cations des éléments du groupe d. Ces éléments ne possèdent pas assez d'électrons pour pouvoir participer à des liaisons covalentes.
Prenons l'exemple du cours qui est l'atome de Bohr (numéro atomique = 5). Cet atome possède donc 5 électrons, sa première couche sera saturé (on place deux électrons dans cette couches, c'est la couche "K"). Sa deuxième couche (couche L) peut contenir jusqu'à 8 électrons, or nous pouvons en placer que 3. Plus les couches situées en périphérie sont saturées, plus le composé est stable. Pour que sa couche soit saturée, notre atome de Bohr devrait donc soit perdre 3 électrons (une couche vide n'existe plus), soit gagner 5 électrons, or ces deux possibilité coutent bien trop cher en énergie et sont donc impossible ! Pour ce qui est de la mise en commun d'électrons, notre atome peut donc partager uniquement ses 3 électrons de valences, seules 3 liaisons pourraient se faire et la couche K ne serait tout de même pas saturé (total de 6 électron), le composé de départ n'obtiendrait pas suffisamment de stabilité par la mise en commun d'électron. Cette solution est donc inutile.
Une dernière solution s'offre alors à nous, il s'agit du cas particulier de la liaison de coordination (ou dative). Cette solution permet à un atome qui est en excès d'électrons (éléments des colonnes 15, 16, et 17) de fournir les 2 électrons nécessaires à la liaison à notre atome en déficit d'électron. L'azote (numéro atomique = 7) possède 5 électrons sur sa couche externe, il pourrait donc saturer sa deuxième couche par la mise en commun de 3 de ses électron de valence (total de 8 électron). Il lui resterait donc un doublet électronique non utilisé, et disponible pour former à lui seul une éventuelle liaison (coordination : don d'un doublet d'électrons).
L'azote va par exemple se lier à 3 hydrogènes (mise en commun d'électrons) pour saturer ses couches et obtenir gain de stabilité (NH3). Il lui reste un doublet non liant. De son côté, le Bohr va faire de même, il se lie à 3 atomes d'hydrogènes par liaison covalente. On obtient donc un BH3 encore instable car ses couche ne sont pas saturées, ce composé est déficitaire en électron, il lui manque 2 électrons pour être stable. Le composé azoté va fournir au bohr son doublet d'électrons. Une liaison de coordination vient de se former entre l'atome de Bohr et l'atome d'azote, la stabilité de ce nouveau composé est optimal.

.png)

